

在eBay各大站點,醫(yī)療和個人康健器械逐漸成為熱門品類。本文將詳細介紹eBay各大站點對醫(yī)療保健設備的法規(guī)和產品認證要求。
一、美國部分
1. 美國FDA認證
FDA是美國食品和藥品管理局(Food and Drug Administration)的縮寫
FDA的官方網站為www.fda.gov
FDA對所有進口到美國或者在美國市場流通的食品和藥品,醫(yī)療器械和具有醫(yī)療功能的保健器械進行管制和規(guī)范。
FDA將醫(yī)療器械按照危險等級劃分為Class I, Class II和Class III,危險等級逐次提高。FDA對醫(yī)療保健設備的分級被規(guī)范在FDA官網下的CDRH數(shù)據(jù)庫中,每一種醫(yī)療器械都對應一個product code,并且給出申請的指導(guide),提示申請者應該符合哪些程序以及提交哪些資料到FDA進行審核。
FDA的認證程序為
1. 申請者在FDA CDRH中確定待申請的醫(yī)療保健設備所屬的product code,并且確定對應的醫(yī)療器械分級。
2. 根據(jù)FDA CDRH的guide準備申請文件,根據(jù)不同分級可能包括a) 電氣安全性測試報告; b) 產品設計原理和說明; c)被FDA批準的其他同類醫(yī)療器械的類同性說明; d) 如果涉及到軟件分析和控制,需要提交軟件設計原理; e) 大部分產品需要提交臨床測試報告和分析報告;
3.提交所有資料到FDA申請批準,在收到完整資料之后FDA會給予申請者一個最終的批準號(K號),該號碼也是最終批準之后在FDA網站上列名的注冊號,但是在獲得FDA最終批準以前不得使用。
4.FDA進行文件審核并對提交文件中的疑惑問題進行質疑,申請者需要在規(guī)定的時間內(90個日歷日)對FDA提出的問題進行解答或者補充資料。(FDA的文件審核周期一般為30個日歷日每輪)
5. FDA對文件審核通過之后,會安排進行工廠檢查,按照FDA的GMP程序(Good Manufacture Practices),由FDA自行安排。
6.在GMP工廠檢查通過之后15個日歷日內,F(xiàn)DA會正式批準該醫(yī)療器械申請并且把注冊信息顯示在FDA官網上供公眾查詢,產品可以合法在美國市場進行銷售和流通。
風險提示: 沒有獲得FDA批準的醫(yī)療器械一般不能通過美國海關的報關審核,并且銷售/使用方需要對因此產生的醫(yī)療事故負擔全部民事和刑事責任。
DA對涉及產品的分類和適用標準
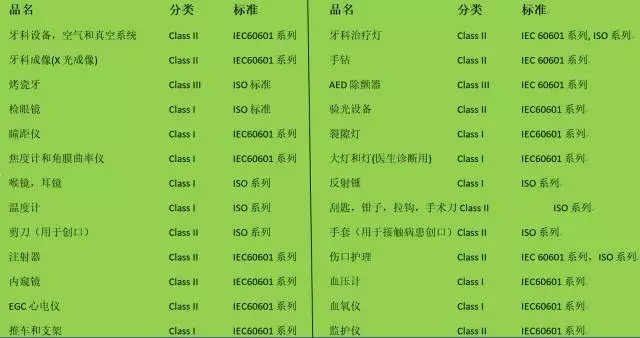
2. 美國FCC認證
FCC是美國聯(lián)邦通訊委員會(Federal Communications Commission)的縮寫。
FCC的官方網站為www.fcc.gov
FCC負責全美境內的頻率分配和合理合法使用,所有使用無線電頻率的醫(yī)療器械產品都需要符合FCC中47 Code of Federal Regulation Part 18的要求。
FCC的認證程序為:
1)申請者選擇被FCC認可的實驗室進行測試并獲得通過的報告。(FCC認可的實驗室可以在FCC官網進行查詢)
2)準備除了報告以外的相關技術文件,包括說明書,電路圖,關鍵元器件清單,標簽等。
3)完成報告和文件準備之后做符合性自我申明,并且在產品上標注FCC標簽(如文中左上標志)(對于有意輻射體/簡單說無線電設備,需要符合FCC Certification Procedure,產品需要在本體上打FCC ID號碼二不是FCC Logo)
風險提示:
沒有獲得FCC認證的適用醫(yī)療器械一般不能通過美國海關的報關審核,并且銷售/使用方需要對因此產生的事故或者不良影響負擔全部民事和刑事責任。
二、加拿大部分
1. CMDCAS認證
加拿大醫(yī)療器械注冊有加拿大衛(wèi)生局(Health Canada)負責,采取政府注冊和第三方質量體系審查的方式。這里所指的第三方,是指被加拿大醫(yī)療器械認證認可機構(CMDCAS, Canadian Medical
Devices Conformity)認可的第三方機構。
加拿大衛(wèi)生局的官方網站是www.hc-sc.gc.ca 類似美國,加拿大也對醫(yī)療器械采取分級制度,分為Class I, Class II, Class III和Class IV, 風險等級逐次提高。
Class I,即一類醫(yī)療器械豁免注冊,在具有CMDCAS認可的質量體系證書后可以直接銷售,二三四類醫(yī)療器械需要進行注冊。
需要提交的資料和CE的資料類似,不同等級的醫(yī)療器械需要提交的資料要求也不相同,可以在Health Canada網站上檢索到具體要求。
具體的注冊流程如下:
1. 申請者根據(jù)Health Canada網站上的guide確定醫(yī)療器械分級(有對應列表確定)
2. 對于非Class I產品,準備質量體系證書和技術資料,遞交Health Canada進行注冊
3. Health Canada進行文件審核,通過后予以注冊并且簽發(fā)醫(yī)療器械許可證
4. 產品可以合法在加拿大銷售。
醫(yī)療器械許可證發(fā)布后,每年11月1日需要向加拿大衛(wèi)生部進行再確認。如果于當年12月31日尚未進行再確認的,醫(yī)療器械許可證(及營業(yè)執(zhí)照相關范圍)自動作廢。
CMDCAS對涉及產品的分類和適用標準
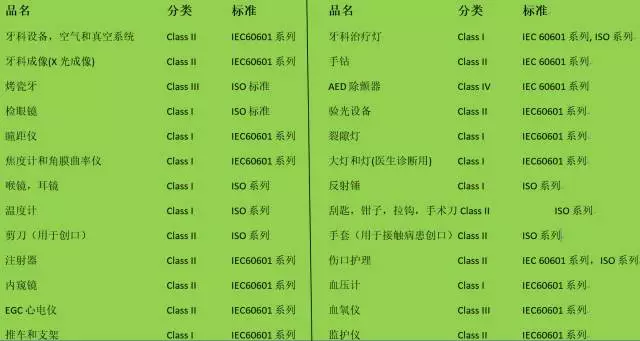
風險提示: 沒有進行CMDCAS注冊的醫(yī)療器械一般不能通過的報關審核,并且銷售/使用方需要對因此產生的醫(yī)療事故負擔全部民事和刑事責任。
2. IC認證
加拿大IC和美國FCC的測試報告技術等同,對于獲得FCC認證或測試報告的產品,如果為有意發(fā)射體(無線電設備),需要提交資料到加拿大工業(yè)局(Industry of Canada, IC)進行換證,如果為無意發(fā)射體(常規(guī)電子產品),需要在原報告中增加加拿大標準(IC),技術內容等同F(xiàn)CC標準。獲得IC證書(或者報告)后產品即可合法在加拿大銷售。
參考的官網網站為www.ic.gc.ca
三、歐洲部分
1. 歐盟CE認證
CE認證是European Conformity的法文縮寫,是產品進入歐盟境內的必要認證,也包括醫(yī)療器械和保健產品。歐盟相關技術規(guī)定可以在www.cenelec.org上查詢。
CE是歐盟于1993年正式設立的產品合格評定程序,由一系列指導文件,指令性文件和標準構成整個程序。
按照產品的風險程度不同,CE制定了guide to the implementation of directives, 規(guī)定了module A到module H的 8種準入程序。自A到H風險等級逐次升高。
Module A為我們最常見的DoC程序,從法律角度無需第三方介入,廠家可以自行根據(jù)符合性證據(jù)(比如自己出具的檢測報告)進行自我符合性聲明。
Module B ~ Module H分別為EC Type Examination到Full Quality Assurance,都不允許廠家自我聲明產品的符合性,需要進行工廠檢查,引入歐盟提名機構(Notified Body)進行文件審核,工廠審核等才能完成符合性程序。
基于選定的認證程序(Module種類),歐盟針對每個類別或者特性的產品規(guī)范了具體的符合性要求,這個規(guī)范稱為歐盟指令(EU Directive),指令中規(guī)定了歐盟和在歐盟生產/銷售產品的責任機構的責任和義務,并且列出了產品需要符合的一般性技術要求范圍(比如安全性,電磁兼容,有毒有害物質管控,廢棄電子電器回收,能效,噪音,排放等等),適用的產品需要符合指令規(guī)定的所有相關技術要求。
每一個技術要求范圍,在指令中一般都不給于具體的測試要求或者標準,這些要求和標準會被規(guī)范在指令的下一級文件(標準和執(zhí)行決議)(Standard and implementation)中,這些被指令涵蓋的標準和執(zhí)行文件每年會由歐盟發(fā)布對應指令的年刊(Official Journey, OJ)給出詳細列表。
執(zhí)行中,申請者需要根據(jù)產品特性選定適用的指令,并找到OJ中列出的相關標準進行檢測證明符合性(對于不在OJ中列出但是必要的安全性標準,歐盟Notified body會給出建議),在符合通過后根據(jù)選定的Module自我宣告或者遞交歐盟相關Notified body審核,并且在通過審核后根據(jù)Module中的規(guī)定在產品本體上貼上CE標簽,或者CE標簽加歐盟Notified Body編號以完成CE符合性程序的所有工作。
歐盟對醫(yī)療器械進行分級管理制度,按照危險等級不同按照93/42/EEC醫(yī)療器械指令分為General Class I, Special Class I; Class IIA, Class IIB, Class III類產品,級別越高危險程度越高。醫(yī)療器械指令Article 19明確規(guī)定了各種醫(yī)療器械的分級要求。
醫(yī)療保健產品的認證程序為
1.申請者按照醫(yī)療器械指令確定待申請的醫(yī)療保健設備所屬的醫(yī)療器械分級。
2.根據(jù)不同分級準備文件資料,可能包括a) 測試報告可能包括安全性,電磁兼容性,無線電特性,化學有毒有害物質管控,廢棄電子電器產品回收測試分析,能效評估;b) 產品設計原理和說明; c) 被FDA批準的其他同類醫(yī)療器械的類同性說明; d) 如果涉及到軟件分析和控制,需要提交軟件設計原理; e)大部分產品需要提交臨床測試報告和分析報告;
3.準備有效的ISO13485工廠質量體系證書
4.將文件和工廠質量體系證書提交歐盟提名機構(Notified Body)進行審核
5.審核過程中Notified Body會就提交的資料進行審核和提出質疑,申請者需要及時進行回復解釋或者補充提交資料
6.在Notified Body審核通過以后,會頒發(fā)CE證書,申請產品本體需要標注該Notified body在歐盟的注冊編號以標示具體哪個Notified Body進行了審核和批準(比如Intertek在醫(yī)療領域的Notified Body號碼是英國0473或者瑞典0413)
7.在獲得CE證書后產品可以合法向歐洲銷售和流通。
風險提示: 沒有獲得Notified Body批準的醫(yī)療器械一般不能通過歐盟海關的報關審核,并且銷售/使用方需要對因此產生的醫(yī)療事故負擔全部民事和刑事責任,后果嚴重!
CE對涉及產品的分類和適用標準
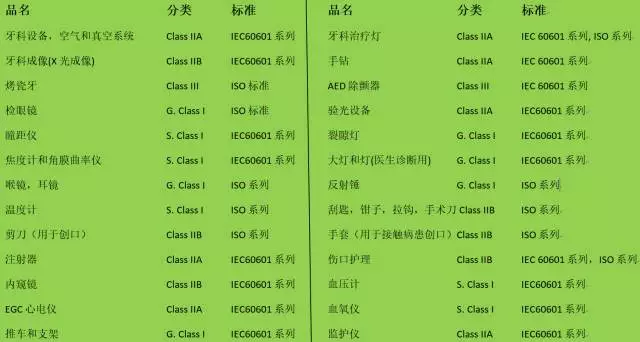
四、澳洲部分
1. 澳洲TGA認證
澳洲醫(yī)療用品管理局(Therapeutic Goods Administration)是負責對進口到澳洲的醫(yī)療器械,藥品和保健產品進行注冊和管制的機構,
官方網站為www.tga.gov.au
澳洲對醫(yī)療器械準入和市場監(jiān)管通過TGA下的兩個部門分管,其中ODA (office of devices authorization)負責產品銷售前的批準(對海外產品也就是準入),OPR(office of product review)負責產品投放市場之后的監(jiān)督管理。
澳洲對醫(yī)療器械的分級制度和歐盟相同,在表述上分為Class I, Class Is, Cass Im, Class IIA, Class IIB和Class III, 危險程度逐次提高。其中Class Is是指帶有消毒功能(sterile)的一類醫(yī)療設備(比如消毒柜),Class Im是指帶有測量讀數(shù)功能(measurement)的一類醫(yī)療設備(比如水銀體溫表),歐盟把這兩類都簡化為特殊一類醫(yī)療器械。
對一類醫(yī)療器械澳洲指管制產品符合性,對除了一類和三類以外的其他醫(yī)療器械管制產品符合性和工廠質量管理體系(ISO13485),對于三類醫(yī)療器械管制產品符合性,工廠質量管理體系和設計控制(Design/type control)
澳洲TGA的注冊程序為:
1. 申請者按照上述TGA規(guī)定確定醫(yī)療產品等級
2. 申請者提供包括被TGA認可的符合性測試報告或者歐盟Notified Body出具的CE證書及其所有對應技術資料和報告,以及澳洲符合性聲明到TGA進行審核
3. TGA進行審核,如果TGA提出質疑可能需要補充材料,如果TGA通過審核,申請者上傳資料到ARTG (Australian Register of Therapeutic Goods)完成注冊
4. 在ARTG上顯示注冊成功之后,信息可以被公眾查詢到并且產品可以合法的投入市場
備注: 此處的申請者是指投放市場或者分銷的澳洲法人,可以是位于澳洲的制造商,或者是位于澳洲的分銷商,但是不是澳洲以外的制造商。
澳洲TGA的具體定義,要求和程序可以在ARGMD(Australia Registration Guide of Medical Devices)上查詢到,包括準入要求,市場監(jiān)督和管理要求等細節(jié)。
風險提示:沒有獲得TGA批準的醫(yī)療器械一般不能通過澳洲海關的報關審核,并且銷售/使用方需要對因此產生的醫(yī)療事故負擔全部民事和刑事責任。
TGA對涉及產品的分類和適用標準
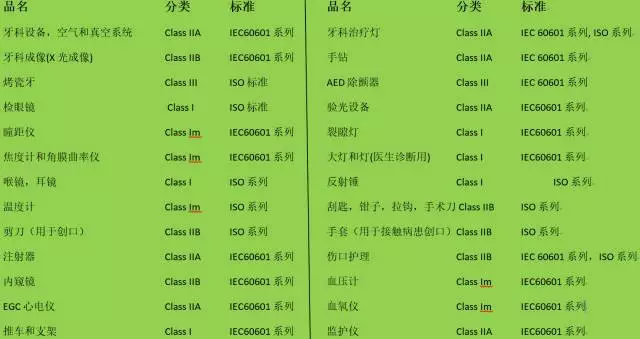
備注: 對于非醫(yī)療器械產品,澳洲有獨立的RCM認證程序進行管制,根據(jù)產品定義來選擇是RCM還是TGA程序
由于各個國家、地區(qū)的認證方式不一,且隨時將由不同機構進行修改,本指南所列的認證方式僅供參考,最新及詳細的步驟請參見各國官方網站。
以上內容屬作者個人觀點,不代表雨果網立場!如有侵權,請聯(lián)系我們。